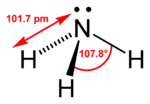അമോണിയ
നൈട്രജൻ ഹൈഡ്രജനുമായി ചേർന്നുണ്ടാകുന്ന വ്യാവസായിക പ്രാധാന്യമുള്ള സംയുക്തമാണ് അമോണിയ. ഇതിൻറെ രാസസമവാക്യം NH3. സാധാരണയായി വാതക രൂപത്തിൽ കാണാറുള്ള ഇതിന് രൂക്ഷ ഗന്ധമാണുള്ളത്. ഔഷധവസ്തുക്കളുടെ നിർമ്മാണത്തിന് നേരിട്ടോ അല്ലാതെയോ അമോണിയ ഉപയോഗിക്കുന്നു. ജൈവവസ്തുക്കളുടെ അഴുകലിന്റെ ഫലമായി അമോണിയ ഉണ്ടാകാറുണ്ട്. 2006-ലെ ആഗോള അമോണിയ ഉല്പാദനം 146.5 മില്യൺ ടൺ ആയിരുന്നു[4].
| |||
| Names | |||
|---|---|---|---|
| IUPAC name
Azane
| |||
| Other names | |||
| Identifiers | |||
3D model (JSmol)
|
|||
| ChemSpider | |||
| ECHA InfoCard | 100.028.760 | ||
PubChem CID
|
|||
| RTECS number |
| ||
| UN number | anhydrous:1005 solutions:2672, 2073, 3318 | ||
CompTox Dashboard (EPA)
|
|||
| InChI | |||
| SMILES | |||
| Properties | |||
| തന്മാത്രാ വാക്യം | |||
| Molar mass | 0 g mol−1 | ||
| Appearance | Colorless gas with strong pungent odor | ||
| സാന്ദ്രത | 0.86 kg/m3 (1.013 bar at boiling point) 0.73 kg/m3 (1.013 bar at 15 °C) 681.9 kg/m3 at -33.3°C (liquid)[2] | ||
| ദ്രവണാങ്കം | |||
| ക്വഥനാങ്കം | |||
| 89.9 g/100 mL at 0 °C | |||
| Basicity (pKb) | 4.75 (reaction with H2O) | ||
| Refractive index (nD) | εr | ||
| Structure | |||
| Trigonal pyramid | |||
| 1.42 D | |||
| Hazards | |||
| Main hazards | Hazardous gas, caustic, corrosive | ||
| R-phrases | R10, R23, R34, R50 | ||
| S-phrases | (S1/2), S16, S36/37/39, S45, S61 | ||
| Flash point | {{{value}}} | ||
| Related compounds | |||
| Other anions | hydroxide (NH3.H2O) | ||
| Other cations | Ammonium (NH4+) | ||
| Related | chloride (NH4Cl) | ||
| Related compounds | ഹൈഡ്രസീൻ Hydrazoic acid Hydroxylamine Chloramine | ||
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |||
അമോണിയക്ക് വ്യാവസായികമായി വളരെയധികം ഉപയോഗങ്ങളുണ്ട്.
ഘടന
തിരുത്തുകVSEPR സിദ്ധാന്ത പ്രകാരം അമോണിയ തന്മാത്രക്ക് ട്രയഗണൽ പിരമിഡൽ ആകൃതിയാണുള്ളത്. ഈ ആകൃതി കാരണം തന്മാത്രക്ക് ഡൈപ്പോൾ മൊമെൻറ് ഉണ്ട്. അതിനാൽ ജലത്തിൽ ധാരാളമായി ലയിക്കുന്നു.
ഉല്പാദനം
തിരുത്തുകഏറ്റവും കൂടുതൽ ഉപയോഗങ്ങളുള്ളതു കൊണ്ട് കൂടുതൽ ഉല്പാദിപ്പിക്കുന്ന അകാർബണിക രാസ സംയുക്തമാണ് അമോണിയ. 2004-ലെ ആഗോള അമോണിയ ഉല്പാദനം 109 മില്യൺ മെട്രിക് ടൺ ആയിരുന്നു[5]. ഫ്രിറ്റ്സ് ഹേബർ എന്ന ജർമ്മൻ രസതന്ത്രഞ്ജനാണ് അമോണിയ വ്യാവസായികമായി നിർമ്മിക്കാനുള്ള പ്രക്രിയ കണ്ടെത്തിയത്. ഈ കണ്ടുപിടിത്തത്തിലേക്ക് ഹേബറെ നയിച്ചത് സ്ഫോടക വസ്തുക്കളും രാസവളങ്ങളും നിർമ്മിക്കാനനുയോജ്യമാതും വൻതോതിൽ ലഭ്യമായതുമായ ഒരു നൈട്രജൻ സംയുക്തം കണ്ടെത്താനുള്ള ശ്രമമായിരുന്നു. ഹൈഡ്രജൻ നൈട്രജനുമായി പ്രതിപ്രവർത്തിപ്പിച്ച് മർദ്ദം, താപം, ഉൽപ്രേരകം എന്നിവ അനുയോജ്യമായി ക്രമീകരിച്ചാണ് ഹേബർ പ്രക്രിയയിൽ അമോണിയ നിർമ്മിക്കുന്നത്.
ഉപയോഗങ്ങൾ
തിരുത്തുകറബ്ബർ പാൽ കട്ടയാവാതിരിക്കാൻ വേണ്ടി ഉപയോഗിക്കുന്നു
വളമായി
തിരുത്തുകഏതാണ്ട് 83 ശതമാനം അമോണിയയും വളമായി അതിന്റെ ലവണ രുപത്തിലോ ലായനി രുപത്തിലോ ഉപയോഗിക്കുന്നു.
അവലംബം
തിരുത്തുക- ↑ Ammonia data at NIST WebBook, last accessed 7 May 2007.
- ↑ http://www.rmtech.net/Anhydrous%20Ammonia.htm
- ↑ MSDS Sheet from W.D. Service Co.
- ↑ Max Appl "Ammonia" in Ullmann's Encyclopedia of Industrial Chemistry, 2006, Wiley-VCH, Weinheim. doi:10.1002/14356007.a02_143.pub2 Article Online Posting Date: December 15, 2006
- ↑ United States Geological Survey publication